Моделирование острого панкреатита на крысах
Аннотация:
Изобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано для моделирования острого панкреатита различной степени тяжести у крыс. Осуществляют введение в общий желчный проток соли желчных кислот. Соли желчных кислот вводят без канюлизации большого сосочка двенадцатиперстной кишки. При моделировании острого панкреатита средней степени тяжести накладывают турникеты на общий желчный проток выше и ниже места впадения дистального протока поджелудочной железы. В общий желчный проток вводят 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг, а затем перевязывают через 15 минут дистальный проток поджелудочной железы и снимают турникеты. При моделировании острого панкреатита тяжелой степени тяжести накладывают два турникета на общий желчный проток выше места впадения дистального протока поджелудочной железы и ниже места впадения проксимального протока добавочной доли поджелудочной железы. При этом вводят 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг и через 15 минут перевязывают оба протока поджелудочной железы крысы. Способ обеспечивает повышение вероятности удачной повторяемости результатов воспроизведения модели острого панкреатита различной степени тяжести у крыс за счет учета обструкции протоковой системы поджелудочной железы крыс и этиологического критерия развития острого панкреатита. 8 ил., 2 табл.
Изобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано для моделирования острого панкреатита у крыс.
Близким решением является способ моделирования, разработанный Р.А. Емельяновым, С.А. Алехиным, Д.П. Назаренко, М.В. Покровским, Т.Г. Покровской, Е.Б. Артюшковой, М.П. Гладченко, описанный в статье Исследование микроциркуляции методом лазердоплеровской флуометрии при остром экспериментальном панкреатите. Кубанский научный медицинский вестник от 30.11.2006 г. Стр. 50-52 г., где для моделирования острого деструктивного панкреатита вместо раствора таурохолата натрия, описанного Aho HJ, Koskensalo SM, и Nevalainen TJ в статье Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol 15: 411-416, 1980 г., используется трансдуоденальное внутри-протоковое введение специальной буферной системы, содержащей соль желчной кислоты при оптимальной для интрапанкреатической активации ферментов рН. Для возможности управления площадью панкреонекроза использовали различное наложение (дистальнее или проксимальнее места впадения добавочного протока поджелудочной железы в общий желчный проток) лигатуры, что обеспечивать развитие тотального или субтотального панкреонекроза.
При использовании данного способа моделирования острого деструктивного панкреатита не учитывалась обструкция протоковой системы поджелудочной железы крыс, этиологический критерий развития острого панкреатита, лежащие в основе большого количества летальных исходов, отличаются от таковых при развитии острого панкреатита в клинике.
Техническим результатом изобретения является повышение вероятности удачной повторяемости результатов воспроизведения модели данного заболевания.
Технический результат достигается тем, что для моделированияострого панкреатита вместо специальной буферной системы мы используем 50% раствор желчи с рН=6,0 в дозе 0,2 мг/кг с последующим его введением в общий желчный проток, без канюлизации большого дуоденального сосочка. Для возможности управления степенью тяжести и площадью поражения поджелудочной железы мы используем этапное наложение турникетов на места впадения добавочных протоков поджелудочной железы и общий желчный проток, что обеспечивает развитие острого панкреатита различной степени тяжести.
Изобретение поясняется фигурами:
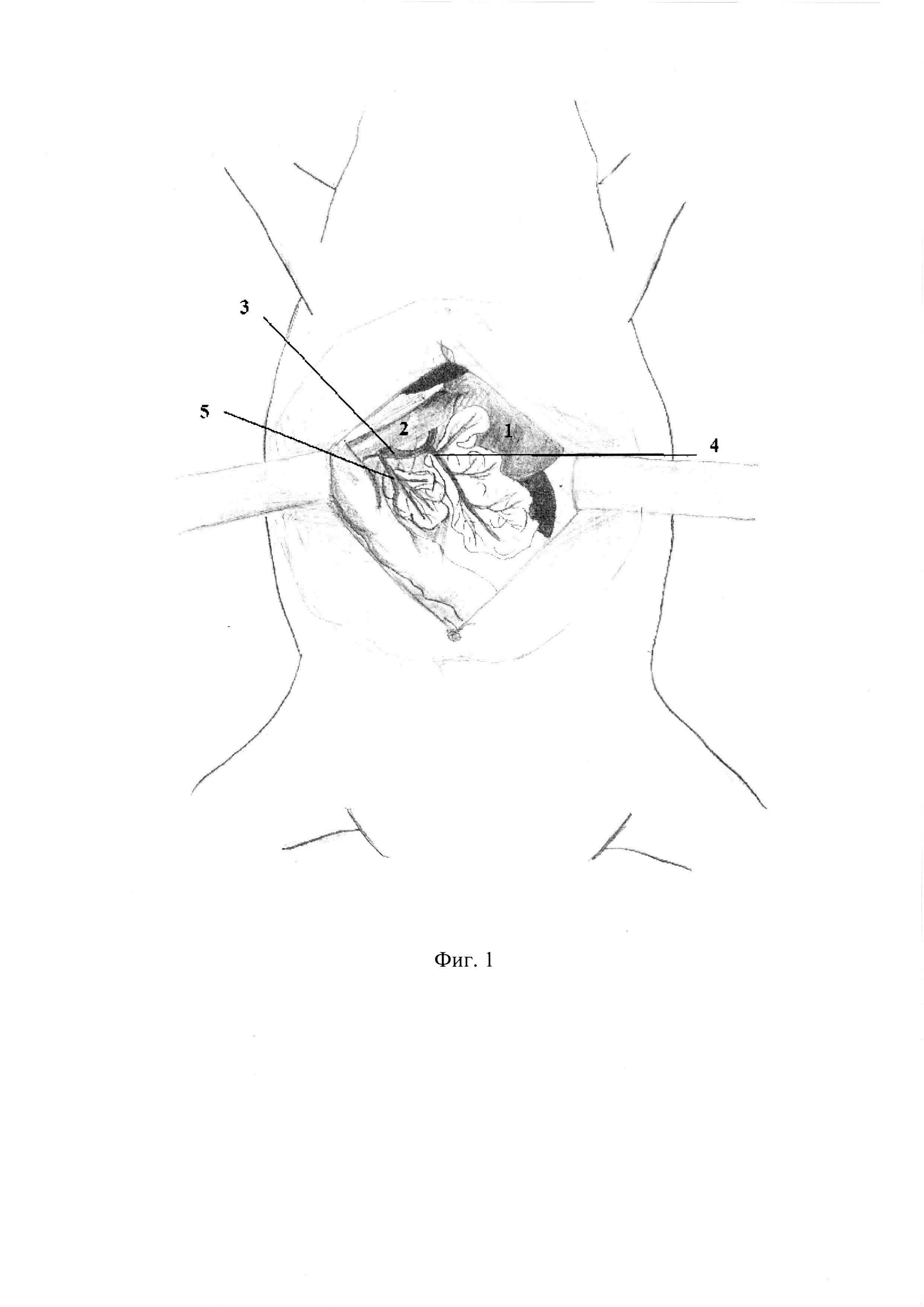
– фиг. 1 – Вскрытие брюшной полости крысы.
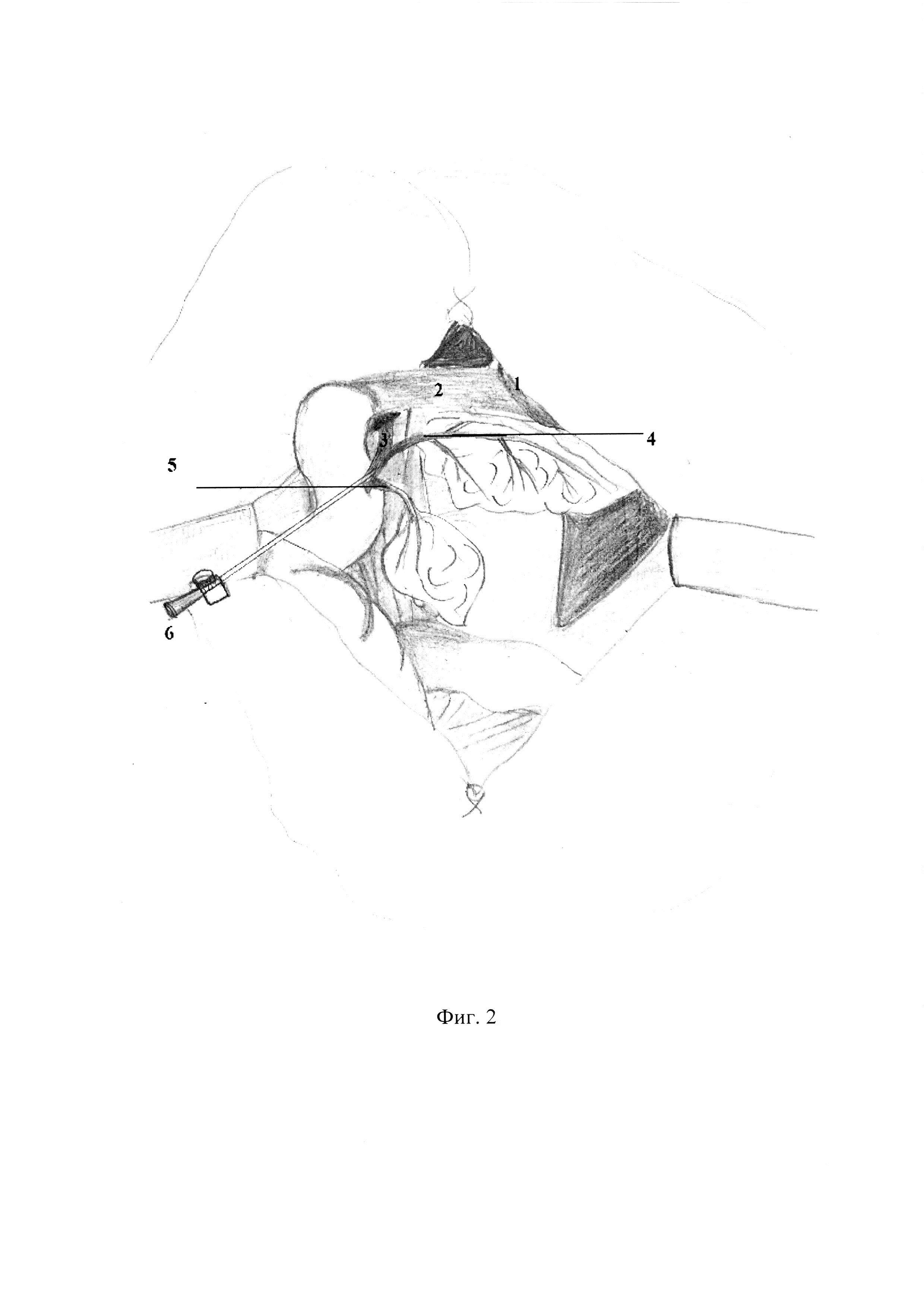
– фиг. 2 – Демонстрация забора желчи.
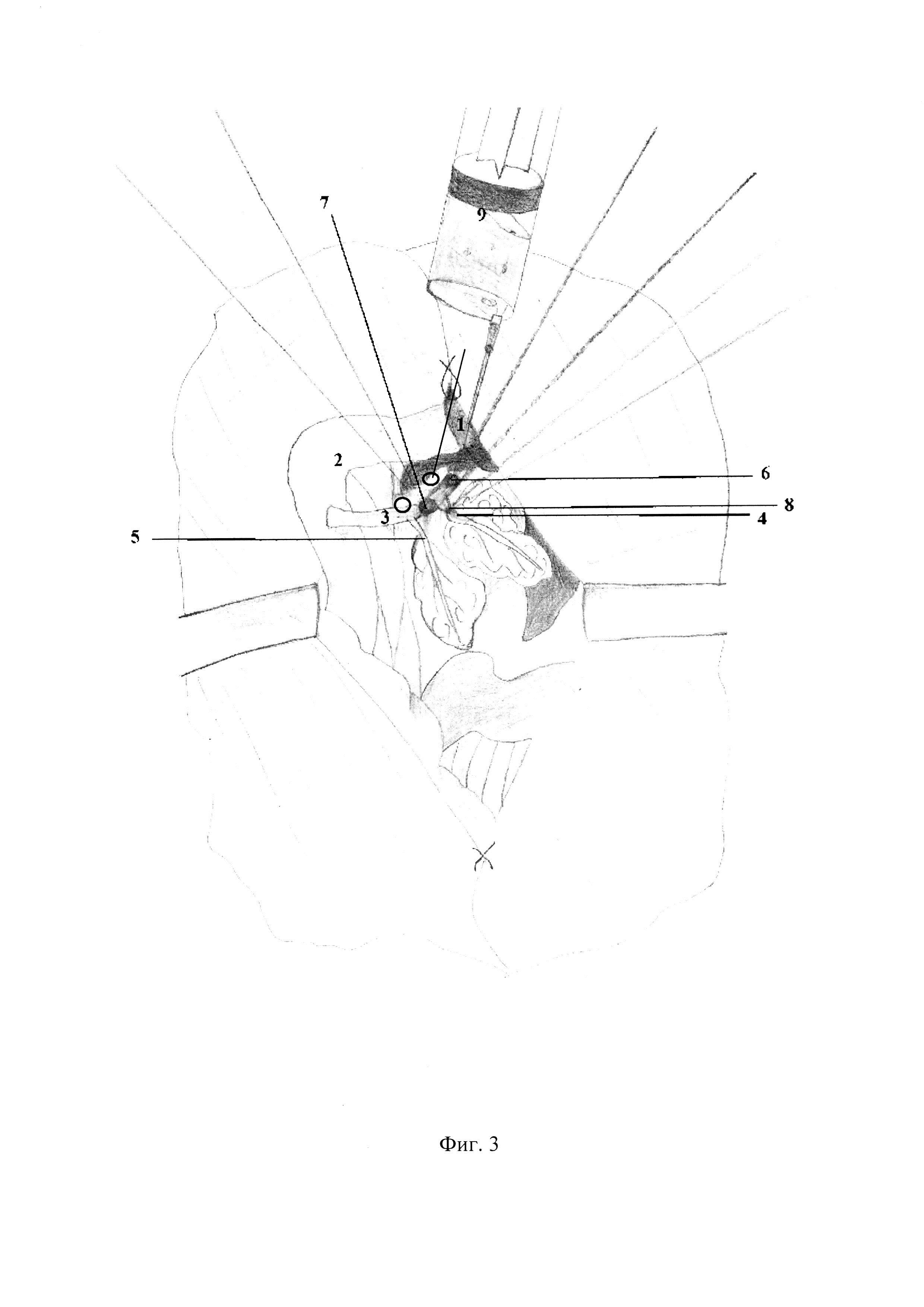
– фиг. 3 – Моделирование острого панкреатита средней степени тяжести.
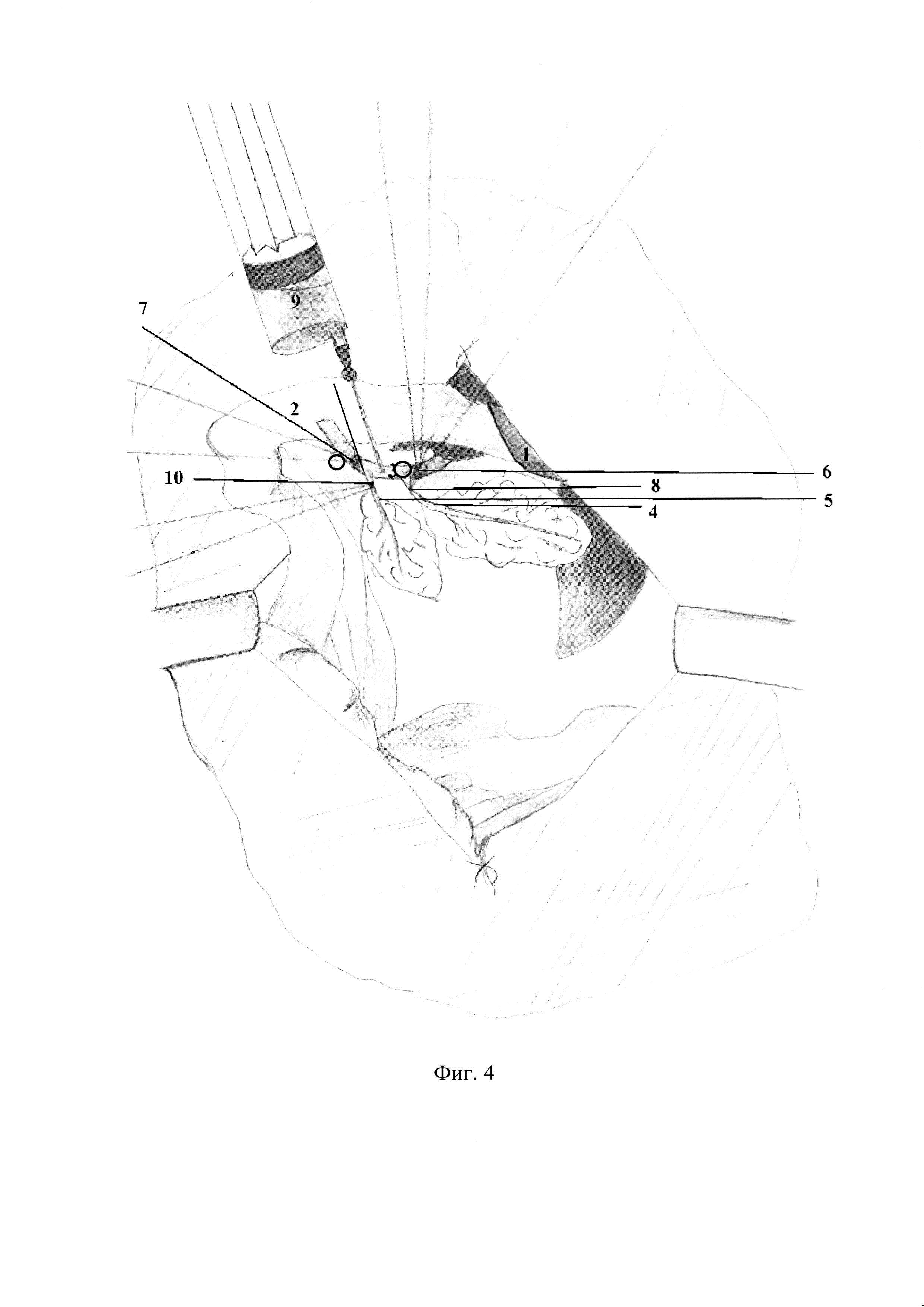
– фиг. 4 – Моделирование острого панкреатита тяжелой степени тяжести.
– фиг. 5 – Микрофото: крупные участки деструкции ткани в виде обширных бесструктурных эозинофильных очагов некроза с выраженной перифокальной воспалительной инфильтрацией преимущественно полиморфноядерными лейкоцитами. Окр. Гематоксилином и эозином (х 100).
– фиг. 6 – Микрофото: некротические изменения распространились на парапанкреатическую клетчатку с ее воспалительной инфильтрацией. Окр. Гематоксилином и эозином (х 100).
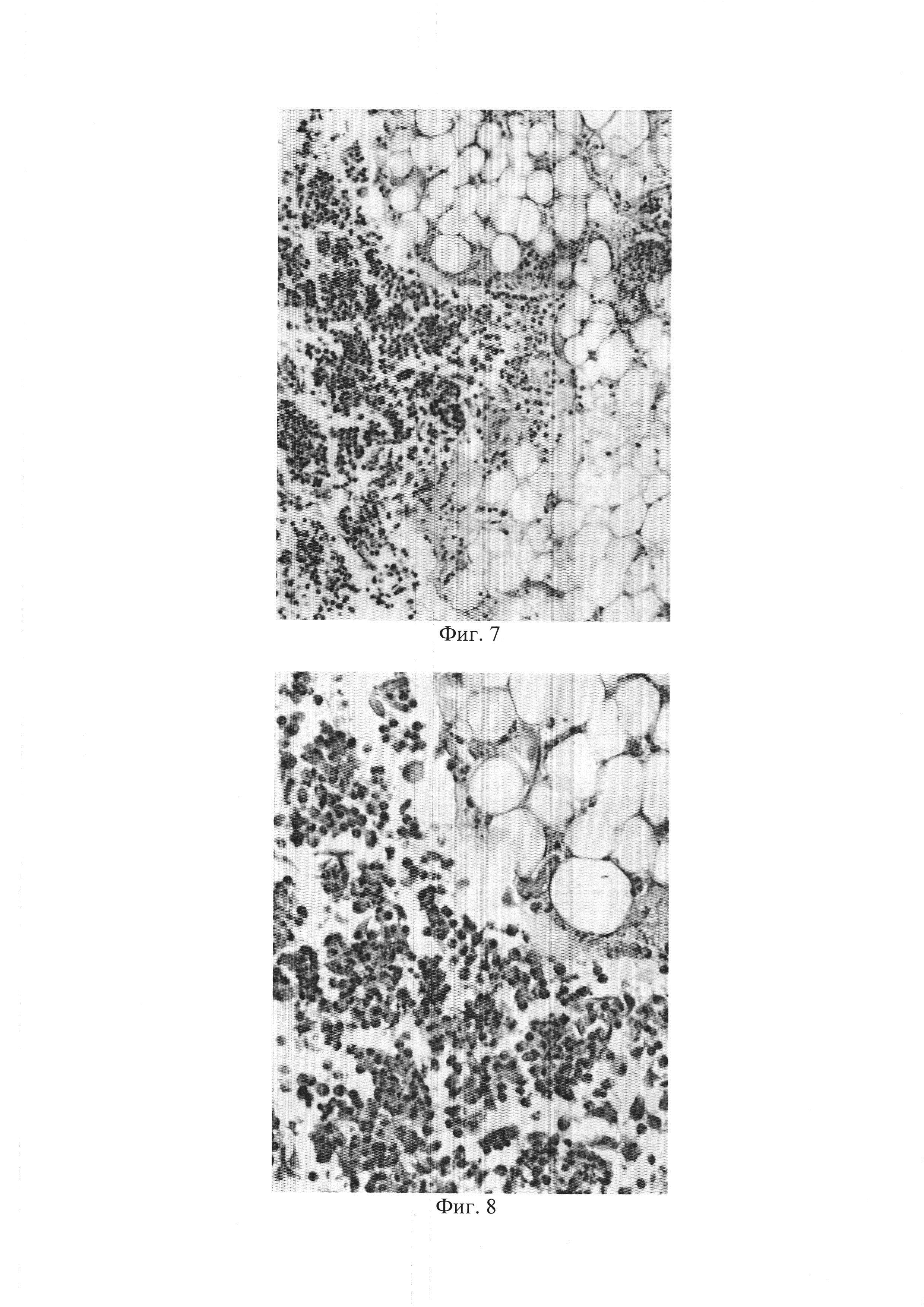
– фиг. 7 – Микрофото: в близи очагов некроза, выраженный интерстициальный отек. Окр. Гематоксилином и эозином (х 100).
– фиг. 8 – Микрофото: в близи очагов некроза, выраженный интерстициальный отек. Окр. Гематоксилином и эозином (х 200).
Способ осуществляется следующим образом.
При вскрытии брюшной полости (фиг. 1) в рану выводится петля двенадцатиперстной кишки (фиг. 1. 2). В гепатодуоденальной связке определяется общий желчный проток крысы (фиг. 1. 3) диаметром 0,27- 0,57 мм. На расстоянии приблизительно 1,5 см от ворот печени в общий желчный проток по задней поверхности впадает дистальный панкреатический проток диаметром приблизительно около 0,2-0,3 мм, что лучше видно при рассечении связки аналоги lig. gastrocolicum и отведении желудка (фиг. 1. 1). При этом мы увидим общий желчного проток, впадающий в него дистальный панкреатический проток (фиг. 1. 4), часть поджелудочной железы, прилежащую к задней стенке желудка и к воротам селезенки. При данном доступе можно увидеть дуоденальную часть поджелудочной железы, дренирующуюся дополнительным протоком добавочной долей поджелудочной железы (фиг. 1. 5), который впадает в общий желчный проток по задней его поверхности на расстоянии около 0,5 см от места вхождения общего желчного протока в стенку двенадцатиперстной кишки. Произвели забор желчи из общего желчного протока с помощью катетера для приготовления ее 50% раствора с рН=6,0 (фиг 2.).
Отличие метода от существующих заключается в возможности моделирования ОП различной степени тяжести без канюлизации большого сосочка двенадцатиперстной кишки за счет воспроизведения модели с наложением турникетов (фиг 3. 6, фиг. 3. 7) на общий желчный проток (фиг. 3.3) выше и ниже места впадения дистального протока поджелудочной железы (фиг. 3. 4) и введения по катетеру 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг (фиг. 3. 9), с последующей перевязкой данного протока (фиг. 3. 8), в результате чего наблюдается формирование ОП средней степени тяжести (фиг. 3). Моделирование ОП тяжелой степени достигается наложением двух турникетов на общий желчный проток выше места впадения дистального протока поджелудочной железы (фиг. 4. 6) и ниже места впадения проксимального протока добавочной доли поджелудочной железы (фиг. 4. 7), введения 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг (фиг. 4. 9), с последующей перевязкой двух протоков поджелудочной железы крысы (фиг 4. 8, фиг. 4. 10). Во всех случаях перевязка протоковой системы поджелудочной железа происходит через 15 мин, затем турникеты снимаются, рана послойно ушивается.
Моделирование различных по степени тяжести форм ОП производили за 5 суток до выведения животных из эксперимента, поскольку в ранее проводимых исследованиях установлено наличие максимально выраженных метаболических изменений в крови и манифестной морфологической картины ОП именно в эти сроки. Для проведения лабораторных тестов на 5-е сутки от моделирования ОП, под наркозом, с тщательным соблюдением правил асептики и антисептики, осуществляли торакотомию и забор крови в объеме до 5 мл из правого желудочка сокращающегося сердца, с последующим выведением животных из эксперимента передозировкой средств для наркоза.
Результаты моделирования острого панкреатита различной степени тяжести.
У животных с экспериментальной моделью обструктивного панкреатита при гистологическом исследовании поджелудочной железы обнаруживались крупные участки деструкции ткани в виде обширных бесструктурных эозинофильных очагов некроза с выраженной перифокальной воспалительной инфильтрацией преимущественно полиморфноядерными лейкоцитами (фиг. 5). При этом некротические изменения распространялись на парапан-креатическую клетчатку с ее воспалительной инфильтрацией (фиг. 6). В сохранившейся ткани поджелудочной железы, особенно вблизи очагов некроза, развивались выраженное полнокровие сосудов и интерстициальный отек (фиг. 7, фиг. 8).


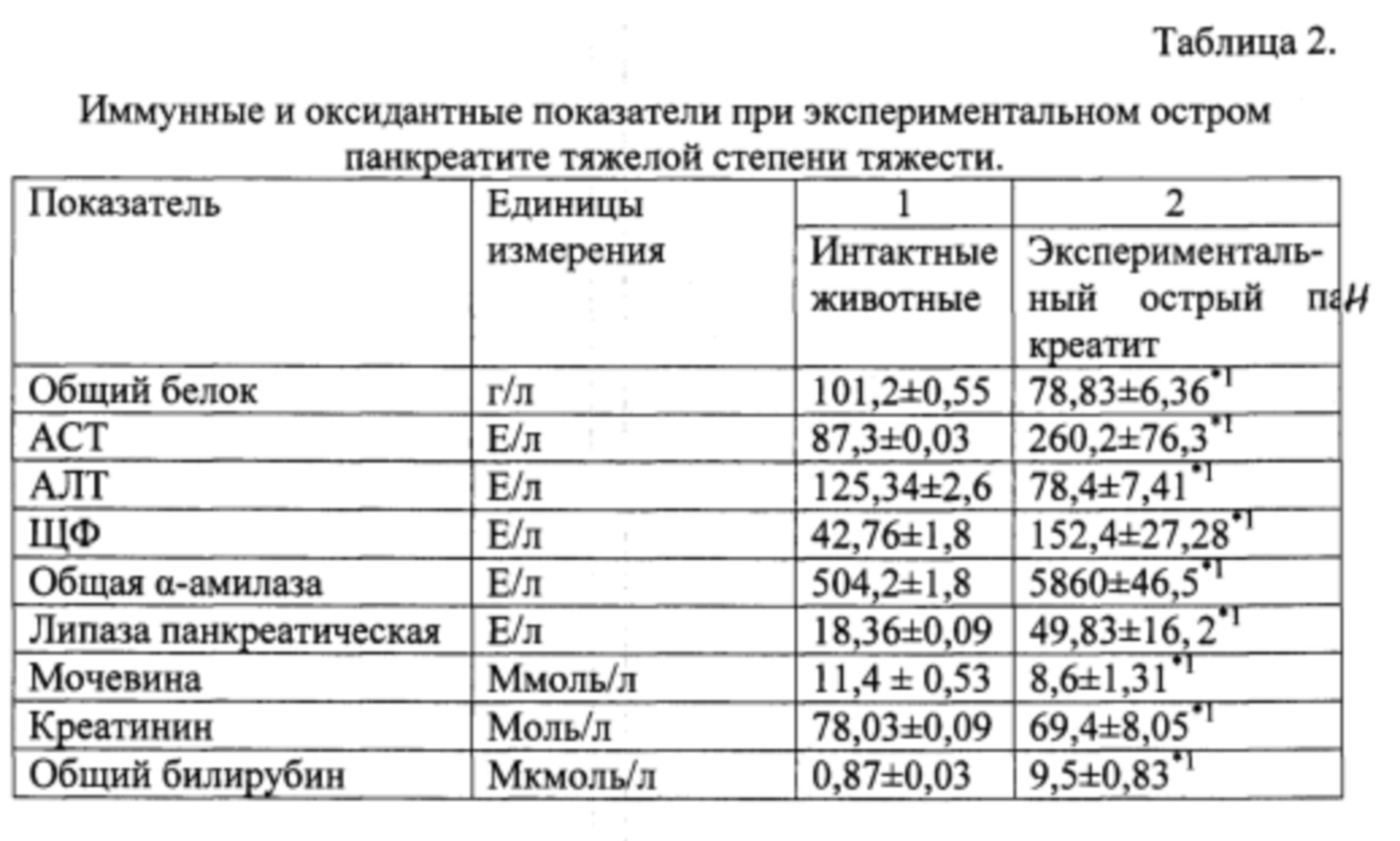
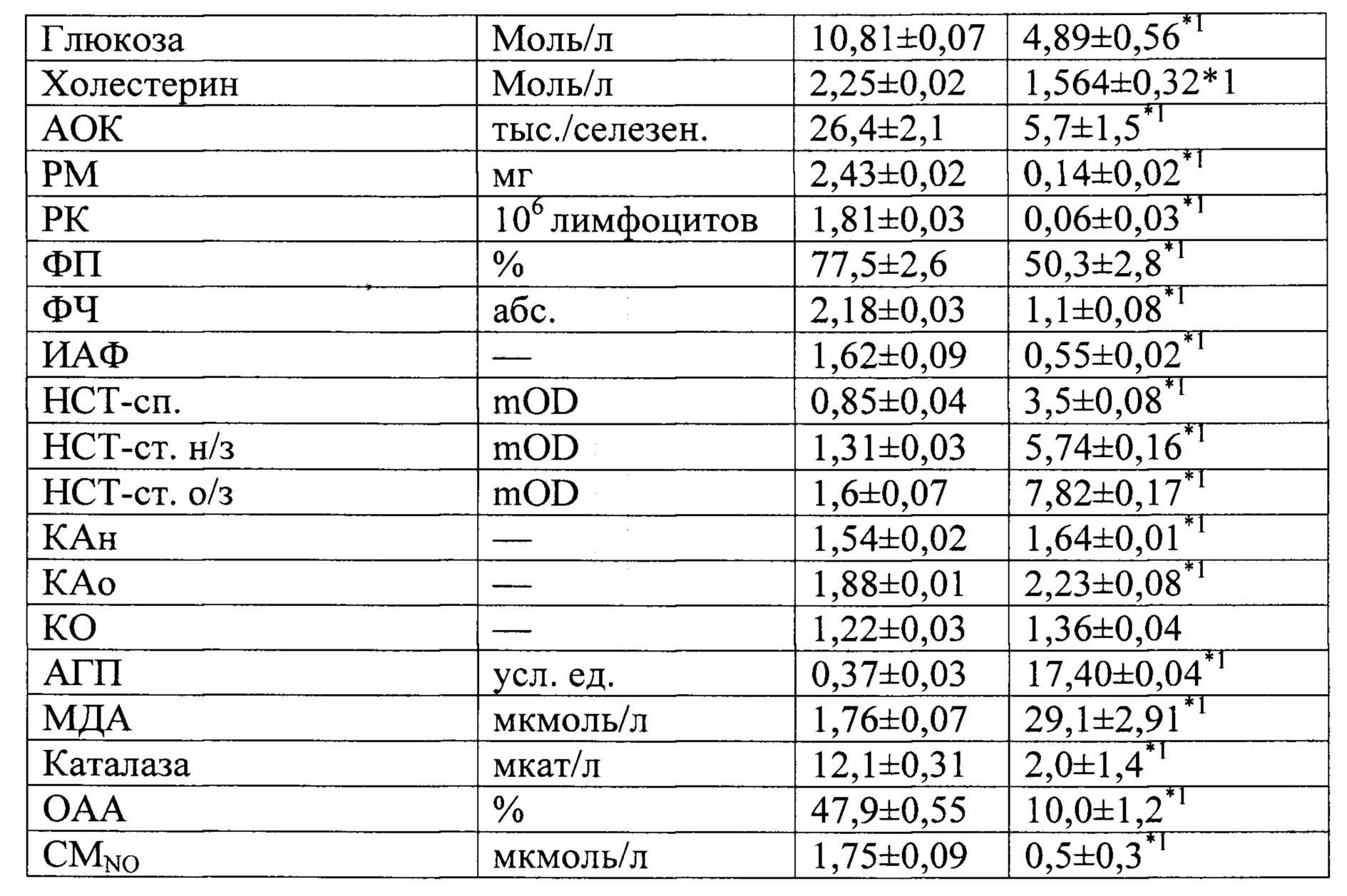
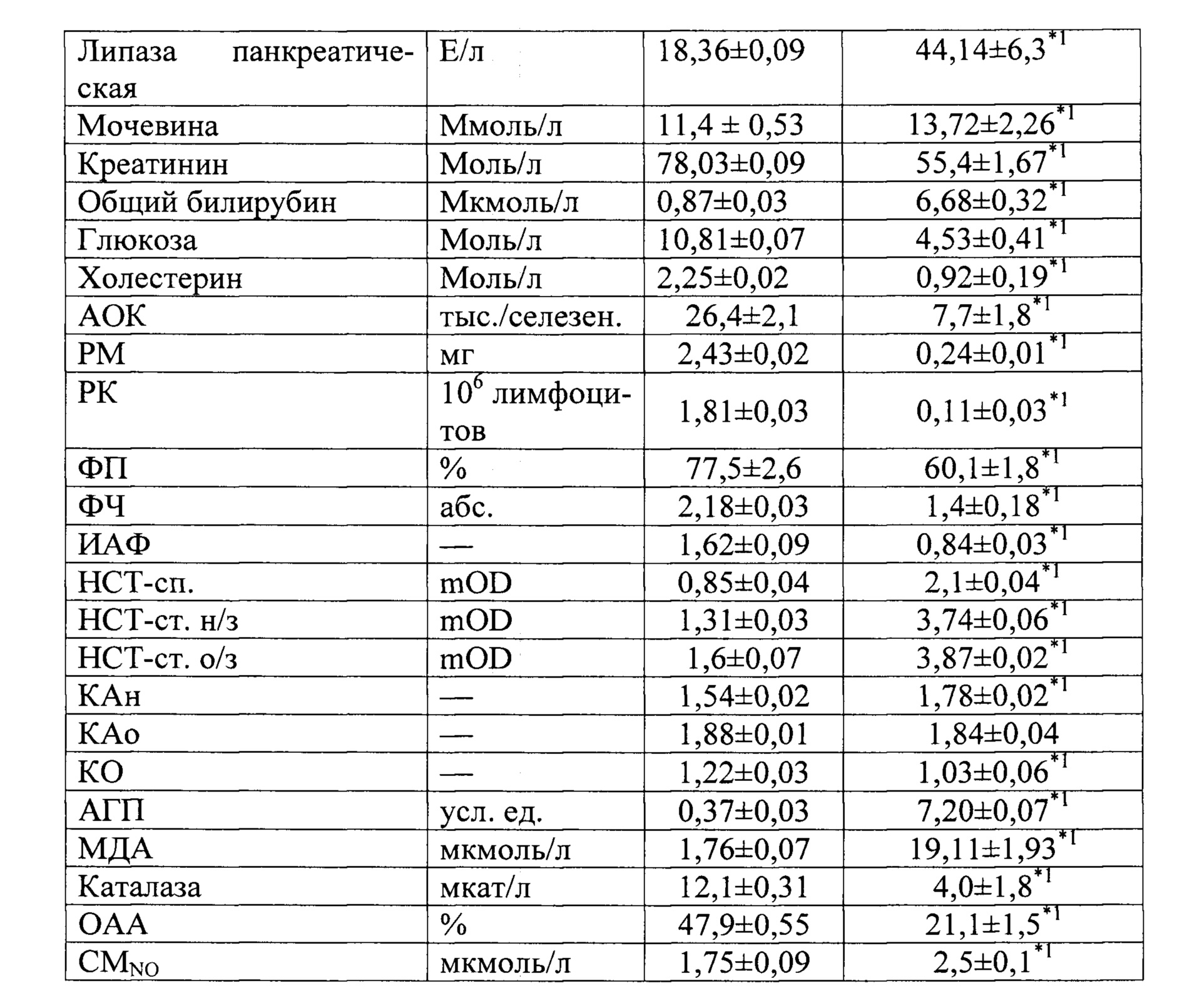
Таким образом, при экспериментальном ОП средней и тяжелой степенях тяжести обнаружены различные по выраженности метаболические и иммунные нарушения с провоспалительной направленностью. При этом отмечается прямая зависимость выраженности иммунометаболических изменений от тяжести ОП. Установленные лабораторные сдвиги позволяют утверждать о развитии острого панкреатита у крысы.
Данный способ позволяет:
– получать высокий достоверный результат операций при минимальной гибели подопытных животных, т.е. высокая повторяемость положительных результатов;
– техническая простота и доступность операций;
– возможность протекания моделируемого заболевания в течение длительного времени до 5 и более суток, что в последующем дает возможность медикаментозного вмешательства и испытания новых лекарственных форм и препаратов для лечения и изучения их влияния.
Способ моделирования острого панкреатита различной степени тяжести у крыс, включающий введение в общий желчный проток соли желчных кислот, отличающийся тем, что соли желчных кислот вводят без канюлизации большого сосочка двенадцатиперстной кишки, при моделировании острого панкреатита средней степени тяжести накладывают турникеты на общий желчный проток выше и ниже места впадения дистального протока поджелудочной железы, в общий желчный проток вводят 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг, а затем перевязывают через 15 минут дистальный проток поджелудочной железы и снимают турникеты, а при моделировании острого панкреатита тяжелой степени тяжести накладывают два турникета на общий желчный проток выше места впадения дистального протока поджелудочной железы и ниже места впадения проксимального протока добавочной доли поджелудочной железы, при этом вводят 50% раствора желчи с рН=6,0 в дозе 0,2 мг/кг и через 15 минут перевязывают оба протока поджелудочной железы крысы.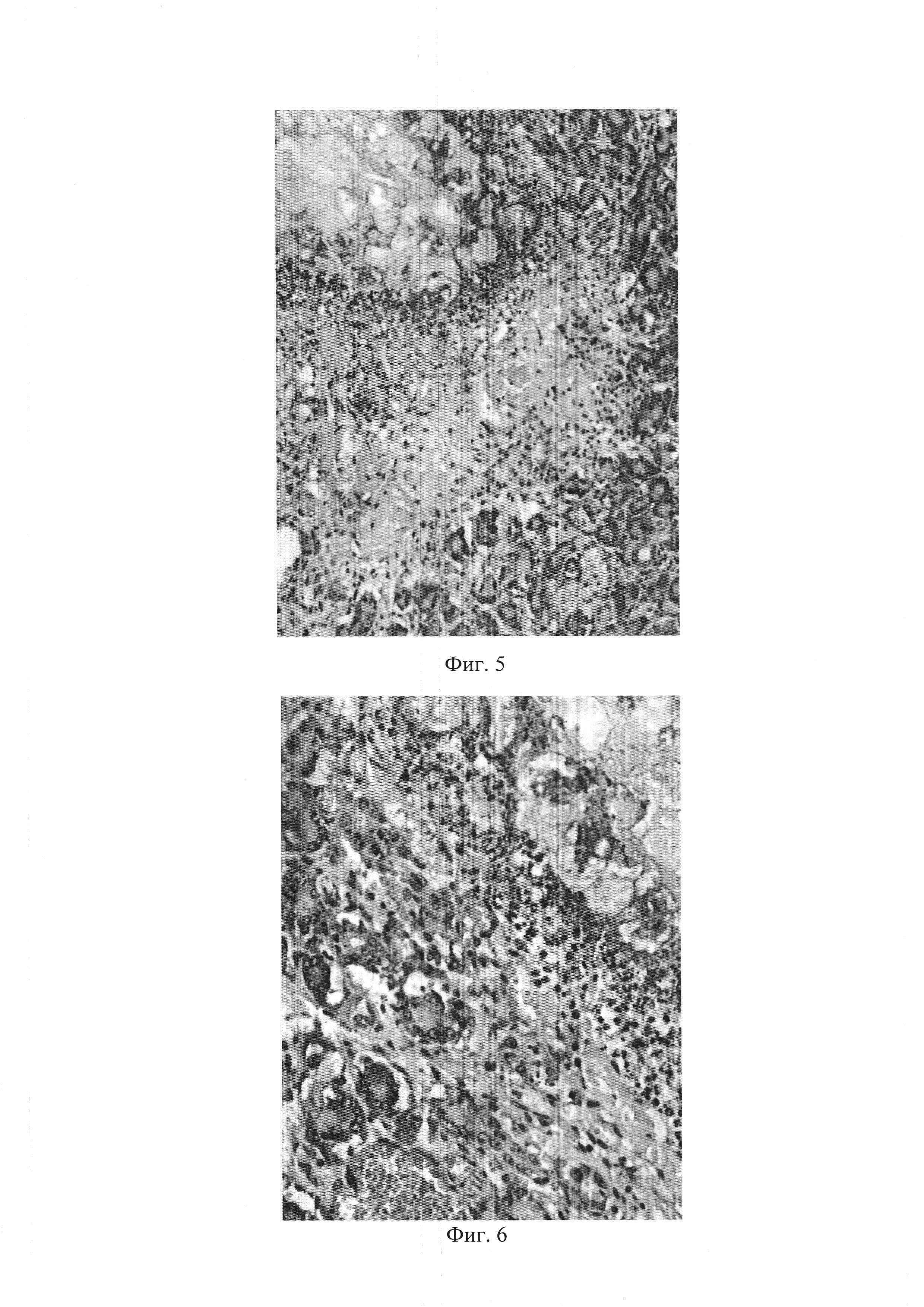
Источник
Изобретение относится к экспериментальной медицине, а именно к экспериментальной форме острого панкреатита, и может быть использовано для моделирования острого деструктивного панкреатита.
Острый панкреатит относится к числу наиболее частых нозологических форм и составляет 3% случаев среди ургентных заболеваний органов брюшной полости. Несмотря на большое количество различных оперативных и консервативных методов лечения смертность при остром панкреатите продолжает оставаться высокой – 10-15%, достигая 30-40% при деструктивных формах.
Высокая летальность диктует необходимость разработки новых методов лечения этого тяжелого заболевания. Испытания новых лекарственных препаратов проводятся на большом количестве экспериментальных животных с острым панкреатитом.
Моделирование острого деструктивного панкреатита на крысах, по нашему мнению, является наиболее обоснованным, т.к. эти лабораторные животные имеют схожую с человеком пищеварительную систему, также питаются тканями органического происхождения, не требуют больших затрат на закупку и содержание.
Известен способ моделирования острого деструктивного панкреатита у крыс, включающий введение в общий желчный проток соли желчных кислот, отличающий тем, что в общий желчный проток вводят 0,3 мл буферного раствора, содержащего 0,3 г трис-гидроксиметил-аминометана и 0,6 г дезоксихолата натрия в 100 мл с рН 8,8, со скоростью потока 0,07 мл в минуту и регулируют площадь панкреонекроза наложением лигатур выше или ниже места впадения дополнительного протока поджелудочной железы в общий желчный проток, см. патент РФ №2236709.
Известен способ моделирования острого некротического панкреатита, включающий деструкцию ткани поджелудочной железы крыс тритоном Х-100, отличающий тем, что в поджелудочную железу взрослой крысы вводят дозу 0,2 мл комплекса, состоящего из 1%-ного водного раствора тритона Х-100 и 10%-ного водного раствора аминокислоты лизина, взятых в равных объемах, получая в течение 24-72 ч сформированный панкреонекроз, см. патент РФ №2286608.
Недостатками этих способов являются их фармакологическая направленность, а это не всегда даст положительный результат в силу различных индивидуальностей каждой подопытной крысы, кроме того они достаточно сложны, т.к. надо строго выдерживать скорости вводимых потоков.
Известен способ по K.Heinkel (1953) и De D Carvalnho (1959), в котором вызывали геморрагический панкреатит у крыс путем временного пережатия желчного протока и введения трансдуоденально через фатеров сосок под минимальным давлением 0,6 мл 2% раствора таухлората натрия или 1 мг трипсина в 0,6 мл физиологического раствора или в таком же объеме 1 мг энтерокиназы и оливкового масла.
Отрицательные стороны
Большая сложность методики требует вскрытия просвета двенадцатиперстной кишки и канюляции большого дуоденального сосочка. Инфицирование брюшной полости содержимым желудочно-кишечного тракта. Высокий процент несостоятельности швов на кишке. Длительность операции. Требует наличия операционной лупы или операционного микроскопа, см. Сыновец А.С., Левицкий А.П., Мичурин В.Ф. Экспериментальный острый панкреатит (обзор литературы). // Журнал “Патологическая физиология”. – 1980. – №1 – с.41-46.
Прототипом является способ, в котором под наркозом после верхней срединной лапаротомии в паранефрон, клетчатку паховых областей и брыжейку тонкой кишки вводят 0,25% раствор новокаина общим объемом 1,0 мл. В рану выводят двенадцатиперстную кишку (ДПК) со связанной с ней протоковой системой частью поджелудочной железы (ПЖ). На переднюю поверхность контакта протокового отдела ПЖ и ДПК укладывают микроирригатор с леской в просвете (турникет), концы которой у верхнего и нижнего краев контакта органов через проколы дорзальной стенки живота выводят наружу. ПЖ и ДПК возвращают в исходное положение. Под визуальным контролем перекрывают протоковую систему ПЖ подтягиванием концов микроирригатора. Брюшную полость орошают 0,25% р-ром новокаина, осушают. Контроль гемостаза. Брюшную полость ушивают послойно наглухо. Через 60 минут из просвета микроирригатора извлекают леску, восстанавливая проходимость протоковой системы ПЖ. Перфорированный микроирригатор используется как для подведения, так для отведения лекарственных веществ и растворов. Если в этом нет необходимости, то последний может быть извлечен вместе с леской.
Способ не требует дорогостоящего оборудования и материалов. Способ не сопровождается вскрытием просвета двенадцатиперстной кишки и канюляцией большого дуоденального сосочка.
Недостатки следующие.
Не выполняется трансиллюминация брыжейки двенадцатиперстной кишки, т.е. сложность в нахождении вирсунгова протока поджелудочной железы. Необходимость в использовании микроирригатора для проведения нити, что повышает травматичность брыжейки двенадцатиперстной кишки, резко увеличивает риск кровотечения из-за повреждения сосудов. Выведение микроирригатора на дорзальную стенку брюшной полости повышает риск повреждения забрюшинных сосудов и почки с мочеточниками, а также вызывает пережатие портальной вены. Нет пережатия краевого сосуда двенадцатиперстной кишки, что позволяет говорить об использовании только одного механизма формирования панкреонекроза, что снижает процент удачных результатов воспроизведения модели данного заболевания.
Источник
Луговой А.О., Заринская С.А., Владимиров В.Г., Попова Е.Ю., Былова Н.А. «Моделирование острого деструктивного панкреатита в эксперименте». Электронный научный журнал «Морфология», 2007, том 1-2. www.morphology.dp.ua
Технической задачей изобретения является повышение вероятности удачных результатов воспроизведения модели данного заболевания.
Для решения поставленной задачи предлагается способ моделирования панкреонекроза у крыс, включающий выполнение оперативного вмешательства, отличающийся тем, что выполняют верхнюю срединную лапаротомию длиной 3,0±0,1 см, затем в полученную рану вводят желудок и двенадцатиперстную кишку вместе с поджелудочной железой и путем трансиллюминации визуализируют вирсунгов проток поджелудочной железы; затем производят под контролем зрения, проведение двойной лигатуры нитью номером «0» при помощи изогнутой колющей хирургической иглы через брыжейку двенадцатиперстной кишки с захватом краевого сосуда и проксимальной трети протока железы у стенки кишки; затем лигатуры выводят на правой боковой стенке брюшной полости и завязывают, ушивают лапаротомную рану; имеется четкая визуализация вирусонгова протока поджелудочной железы; выведение лигатуры на боковую стенку брюшной полости исключает повреждение почек, мочеточника и крупных сосудов, уменьшает травму тканей брыжейки; время протекания болезни после операции составляет 7 и более суток, а это позволяет применять для апробации новые лекарственные формы.
Таким образом, данный способ:
– позволяет минимизировать время операции;
– позволяет получать высокий достоверный результат операций при минимальной гибели подопытных животных, т.е. высокая повторяемость положительных результатов;
– обеспечивает техническую простоту и доступность операций;
– обеспечивает возможность протекания моделируемого заболевания в течение длительного времени с возможностью медикаментозного вмешательства и испытания новых лекарственных форм и препаратов для лечения и изучения их влияния.
Следует отметить, что предлагаемый способ соответствует основному экономическому постулату: «стоимость-эффективность» и значительно превышает по этому показателю все известные другие способы.
Изобретение относится к экспериментальной медицине, может быть использован для моделирования острого деструктивного панкреатита. Технической задачей изобретения является повышение вероятности удачных результатов воспроизведения модели данного заболевания. Для решения поставленной задачи предлагается способ моделирования панкреонекроза у крыс, основанный на основе оперативного вмешательства, отличающийся тем, что выполняют верхнюю срединную лапаротомию длиной 3,0±0,1 см. В полученную рану вводят желудок и двенадцатиперстную кишку вместе с поджелудочной железой. Путем трансиллюминации визуализируют вирсунгов проток поджелудочной железы. Проводят под контролем зрения двойную лигатуру нитью номером «0» через брыжейку двенадцатиперстной кишки с захватом краевого сосуда и проксимальной трети протока железы у стенки кишки. Лигатуры выводят на правой боковой стенке брюшной полости и завязывают. Ушивают лапаротомную рану. Имеется четкая визуализация вирусонгова протока поджелудочной железы. Способ исключает повреждение почек, мочеточника и крупных сосудов, уменьшает травму тканей брыжейки, позволяет применять для апробации новые лекарственные формы. 3 з.п.ф-лы.
1. Способ моделирования панкреонекроза у крыс, включающий выполнение оперативного вмешательства, отличающийся тем, что выполняют верхнюю срединную лапаротомию длиной (3,0±0,1) см, затем в полученную рану вводят желудок и двенадцатиперстную кишку вместе с поджелудочной железой и путем трансиллюминации визуализируют вирсунгов проток поджелудочной железы; затем производят под контролем зрения проведение двойной лигатуры нитью номером «0» через брыжейку двенадцатиперстной кишки с захватом краевого сосуда и проксимальной трети протока железы у стенки кишки; затем лигатуры выводят на правой боковой стенке брюшной полости и завязывают, ушивают лапаротомную рану.
2. Способ по п.1, отличающийся тем, что имеется четкая визуализация вирусонгова протока поджелудочной железы.
3. Способ по п.1, отличающийся тем, что выведение лигатуры на боковую стенку брюшной полости исключает повреждение почек, мочеточника и крупных сосудов, уменьшает травму тканей брыжейки.
4. Способ по п.1, отличающийся тем, что время протекания болезни после операции составляет 7 и более суток, а это позволяет применять для апробации новые лекарственные формы.
Источник
