Синдром полиорганной недостаточности при панкреатите
Библиографическое описание:
Нестеренко, С. П. Оценка полиорганной недостаточности при остром панкреатите / С. П. Нестеренко. — Текст : непосредственный // Молодой ученый. — 2014. — № 19 (78). — С. 112-115. — URL: https://moluch.ru/archive/78/13569/ (дата обращения: 07.09.2020).
Изучено функциональное состояние органов/систем при различных клинико-морфологических формах острого панкреатита. Установлены сроки и последовательность поражения органов и систем при данной патологии.
Ключевые слова: острый панкреатит, полиорганная недостаточность.
Синдром полиорганной недостаточности в настоящее время определяется как универсальное поражение двух и более органов и систем организма в результате тяжёлой неспецифической стресс-реакции на множественные этиологические факторы, когда нарушения физиологических функций отдельных органов и систем не могут спонтанно восстанавливаться путём ауторегуляции и требуют частичной или полной коррекции или протезирования утраченных функций [1].
Несмотря на определенные достижения последних лет в улучшении диагностики, прогнозирования и лечения, острый панкреатит остается одной из актуальных проблем неотложной хирургии и интенсивной терапии, что обусловлено неуклонным ростом заболеваемости, увеличением доли случаев некротического панкреатита и стабильно высокими показателями летальности [1,3,6,7].
Согласно сборной статистике, в зависимости от демографических и этнических особенностей, уровня экономического и социального развития региона число случаев острого панкреатита варьирует от 5 до 80 на 100 тыс. населения в год [2,3,4]. В структуре острой хирургической патологии органов брюшной полости общехирургических стационаров острый панкреатит вышел на первое место по частоте, опережая по темпам роста заболеваемости прочие нозологические формы [3,5,6,7], при этом удельный вес больных острым панкреатитом составляет 10–25 % [4,5,6,7], а по отдельным сведениям достигает 40 % [4]. В литературных источниках последних лет достаточно полно освещены этиологические моменты, приводящие к развитию острого панкреатита, однако патогенетические механизмы развития заболевания до конца не раскрыты. Одним из недостаточно изученных остается вопрос содружественного поражения различных органов. Поэтому разработка новых схем лечения этой грозной патологии не может не базироваться на знаниях этого аспекта болезни
Цель: установить последовательность поражения органов при различных формах острого панкреатита.
Задачи:
1. Оценить функциональное состояние органов и систем при различных формах острого панкреатита по В. В. Чаленко (1998);
2. Установить сроки поражения органов в зависимости от момента начала заболевания.
Материал и методы
В основу работы положен ретроспективный анализ историй болезни 77 пациентов с острым панкреатитом, находившихся на лечении в 432 ГВКМЦ г. Минска с 2007 по 2013 гг.
Результаты и обсуждения
При анализе историй болезни пациентов было установлено следующее: мужчины чаще заболевают панкреатитом (примерно 90 %, соответственно 10 % — женщины). Средний возраст 50 лет±5 лет. Алкоголь как этиологический фактор стоит на первом месте, патология билиарного тракта на втором (у женщин на первом месте заболевания билиарной системы). 50 % больных при отечном панкреатите поступают до 1 суток; 30 % больных при неинфицированном панкреатите поступают до 1 суток, 37 %-позже 3 суток; 100 % больных при инфицированном панкреатите поступают позже 3 суток (таблица 1).
Таблица 1
Характеристика сравниваемых групп
Показатель | Отечный | Неинфицированный | Инфицированный |
Пол: 1. мужчины 2. женщины | 90 % 10 % | 91,5 % 8,5 % | 89 % 11 % |
Возраст | 57±5лет | 50±5лет | 46±5лет |
Этиология: 1. алиментарный 2. билиарный 3. прочие причины | 66 % 11 % 23 % | 71 % 24 % 5 % | 77 % — 23 % |
Сроки от начала заболевания: 1. до 12 ч 2. 13–24 ч 3. 25–72 ч 4. позже 72 ч | 55 % — 33 % 12 % | 33 % 15 % 15 % 37 % | — — — 100 % |
Для оценки функционального состояния органов и систем использовали классификацию по В. В. Чаленко (1998), согласно которой выделяют удовлетворительную функцию, компенсированную недостаточность, несостоятельность функции органа.
Функцию печени оценивали по показателям:
1. Билирубина;
2. АсАТ/АлАТ (коэффициент де Ритиса).
Поступление больных в разные сроки позволило нам выявить развитие органной недостаточности (рис. 1).
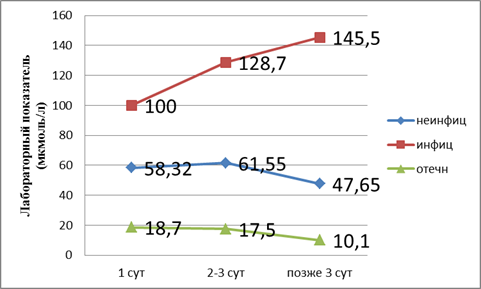
Рис. 1. Показатели билирубина в динамике
Из графика следует, что, согласно классификации по В. В. Чаленко, при отечном панкреатите развивается дисфункция печени, так как лабораторные показатели в пределах верхней границы нормы. При неинфицированном — компенсированная недостаточность. При инфицированном панкреатите развивается декомпенсированная недостаточность печени. Поражение печени при неинфицированном панкреатите происходит на третьи сутки. Далее при адекватном лечении процесс купируется. При инфицированном панкреатите мы наблюдаем рост показателей билирубина.
Если оценку произвести по коэффициенту де Ритиса (рис. 2), то можно сказать, что, как и при оценке показателя билирубина, при отечном панкреатите развивается дисфункция печени, так как лабораторные показатели в пределах верхней границы нормы. При неинфицированном — компенсированная недостаточность. При инфицированном панкреатите развивается декомпенсированная недостаточность печени.
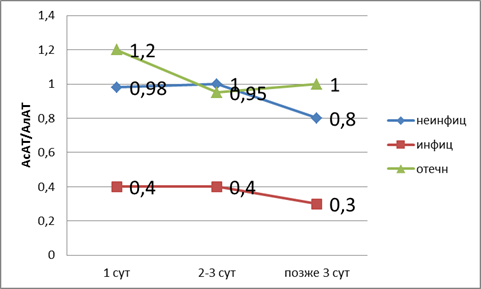
Рис. 2. Показатели коэффициента де Ритиса
Функцию почек оценивали по показателям креатинина и мочевины в крови (таблица 2).
Таблица 2
Изменение показателей креатинина и мочевины
Срок от момента заболевания | Отечный | Неинфицированный | Инфицированный | |||
Креатинин (мкмоль/л) | Мочевина (ммоль/л) | Креатинин (мкмоль/л) | Мочевина (ммоль/л) | Креатинин (мкмоль/л) | Мочевина (ммоль/л) | |
1 сутки | 110 | 8,025 | 128,44 | 8,5 | 143,2 | 9,7 |
2–3 сутки | 100,54 | 7,55 | 145,6 | 9,8 | 162,5 | 10,26 |
Позже 3 сут | 80,75 | 6,3 | 100,3 | 7,2 | 204,86 | 11,3 |
При отечном панкреатите развивается дисфункция почек, так как лабораторные показатели в пределах верхней границы нормы. При неинфицированном-компенсированная недостаточность почек. При инфицированном панкреатите развивается декомпенсированная недостаточность. Поражение почек происходит при неинфицированном панкреатите на третьи сутки, но при адекватной терапии процесс купируется. При инфицированном панкреатите мы наблюдаем рост лабораторных показателей креатинина и мочевины.
Функцию легких оценивали по показателям pCO2, pO2 в венозной крови и рентгенологическому признаку. В результате исследования установлено, что при отечном панкреатите развивается дисфункция легких, так как лабораторные показатели в пределах верхней границы нормы. При неинфицированном развивается компенсированная недостаточность, а при инфицированном панкреатите развивается декомпенсированная недостаточность легких. Поражение легких происходит при неинфицированном панкреатите через 24 часа с момента заболевания, но при адекватной терапии процесс купируется. При инфицированном панкреатите мы наблюдаем рост лабораторных показателей. Рентгенологически при отечном панкреатите изменений со стороны легких не выявлено. При неинфицированном рентгенологически встречаются в 39 % реактивный плеврит, 4 % составили пневмонии. При инфицированном панкреатите в 68 % встречается реактивный плеврит, пневмонии составили 7 %.
Выводы:
1. При панкреатите возникает поражение органов-мишеней: легких, печени и почек с нарушением функции;
2. Поражение легких возникает одним из первых (через 24 часа от момента заболевания) и проявляется развитием РДСВ;
3. Вовлечение в патологический процесс печени и почек происходит позднее — через 72 часа от начала заболевания;
4. При отечном панкреатите, который носит абортивное течение, развивается дисфункция органа. При неинфицированном — компенсированная недостаточность, а при инфицированном панкреатите развивается декомпенсированная недостаточность функции органа.
Литература:
1. Голуб, И. Е. Полиорганная недостаточность: Учебное пособие / И. Е. Голуб, Л. В. Сорокина, Е. С. Нетесин. — Иркутск: ИГМУ. — 2011. — 25 с.
2. Рузавина, А. В. Системные факторы прогрессирования острого панкреатита: автореф. дис. канд. мед. наук: 14.01.17 / А. П. Власов. — Ульяновск, 2012. — 17с.
3. Семенова, А. С. Оценка эндогенной интоксикации при остром панкреатите / А. С. Семенова // Поколение СГМУ 2003: новые рубежи: Сб. научно-практической конференции СГМУ. — Саратов, 2003. — С. 44.
4. Багненко, С. Ф. Хирургическая панкреатология / С. Ф. Багненко, А. А. Курыгин, Г. И. Синченко. — СПб.: Издательство «Речь», 2009. — 603 с.
5. Балныков, С. И. Прогнозирование исхода заболевания у больных некротическим панкреатитом / С. И. Балныков, Т. Ф. Петренко // Хирургия. — 2010. — № 3. — С. 57–59.
6. Гальперин, Э. И. Панкреонекроз: неиспользованные резервы лечения (дискуссионные вопросы к круглому столу) / Э. И. Гальперин, Т. Г. Дюжева // Анналы хирург. гепатологии. — 2007. — Т. 12, № 2. — С. 46–51.
7. Клиническая хирургия: национальное руководство: в 3 т. / под ред. В. С. Савельева, А. И. Кириенко. — М.: ГЭОТАР-Медиа, 2009. — т. 2. — 832 с.
Основные термины (генерируются автоматически): инфицированный панкреатит, острый панкреатит, отечный панкреатит, компенсированная недостаточность, верхняя граница нормы, неинфицированный панкреатит, момент заболевания, показатель, сутки, функциональное состояние органов.
Источник
Введение
Синдром полиорганной недостаточности (СПОН) определяется как универсальное поражение всех органов и систем организма в результате тяжелой неспецифической стресс-реакции, к которой относится и острый панкреатит (ОП), и не может спонтанно восстанавливаться путем ауторегуляции, требуя частичной или полной коррекции или протезирования утраченных функций.
Возникающая недостаточность какой-либо одной системы последовательно вовлекает в патологический процесс другие системы, в результате чего нарушаются их функции с развитием в дальнейшем и их недостаточности.
Fereira et al. (2002) отметил, что летальность, обусловленная СПОН, остается высокой и зависит от количества систем, вовлеченных в патологический процесс. Так, при недостаточности двух систем летальность составляет 30–40 %, а трех-четырех — 90–97 %.
По данным различных авторов (В.В. Бойко с соавт., 2002; О.Н. Песоцкий, 2003; Beger et al., 1998 и др.), у 20–30 % больных острым панкреатитом заболевание протекает тяжело из-за возникающей ранней (токсической) или поздней (септической) полиорганной недостаточности.
Многочисленные литературные данные (И.А. Криворучко, 1997; В.И. Бондарев с соавт., 2005; Maher O. Osman et al., 1999; C.D. Johnson et al., 2004 и др.) подтверждают, что основой развития СПОН является ССВО (синдром системного воспалительного ответа), который характеризуется продукцией провоспалительных цитокинов и других медиаторов повреждения и воспаления. Разница между ними состоит лишь во времени возникновения, причем ССВО — это процесс, а СПОН — исход этого процесса.
Таким образом, причины развития СПОН разнообразны и сложны. Однако до настоящего времени отсутствуют единые представления о его профилактике и лечении.
Цель работы — оптимизация профилактики развития СПОН у больных острым панкреатитом (ОП).
Материалы и методы
Нами проведены ретроспективные и проспективные исследования у 134 больных острым панкреатитом, находившихся на лечении в Харьковской городской больнице скорой медицинской помощи и в Институте общей и неотложной хирургии АМН Украины в 2001–2005 гг. Все больные были разделены на две клинические группы: первая (группа сравнения) — 66 человек, у которых проведены анализ клинических проявлений, оценка их состояния и результатов проведенного лечения; вторая (основная) — 68 человек, к которым применены этапная индивидуализированная оценка тяжести течения основного патологического процесса, диагностика и профилактика развития возможных осложнений.
Для интегральной оценки тяжести состояния больных острым панкреатитом (ОП) и возможного прогнозирования возникновения СПОН мы использовали шкалы Ranson (1994) и APACHE II (W. Knaus et al., 1985). Эта оценка играет важную роль в оптимизации лечебной тактики и предотвращении возможных осложнений.
Распределение больных по виду панкреатита проводилось в соответствии с классификацией, предложенной H.G. Beger (1991) и получившей признание на симпозиуме в Атланте в 1992 году. Согласно этой классификации больные были распределены следующим образом (табл. 1).
Из приведенных данных видно, что наиболее часто у больных наблюдался неинфицированный панкреонекроз (соответственно 63,7 и 80,9 %).
Большинство вышеуказанных больных поступили в стационар позже 24 часов с момента заболевания: 32 (48,5 %) — в первой и 35 (51,5 %) — во второй группе.
Как в первой, так и во второй клинической группе наиболее часто встречался алкогольный (соответственно 57,6 и 60,3 %), билиарный (36,4 % и 35,3 %) и идиопатический (6,1 и 4,4 %) ОП. Течение заболевания у всех анализируемых больных характеризовалось явлениями ССВО в соответствии с критериями R. Bone et al. (1992), а 16,6 % больных первой и 19,1 % больных второй группы поступали в стационар с явлениями шока и СПОН (соответственно 31,8 и 33,8 %) (табл. 2).
Х = 1,511, p = 0,825.
Как в группе сравнения, так и в основной группе преобладали больные с массивным поражением ПЖ. Лишь у 13,6 % больных первой и у 11,8 % больных второй группы наблюдалась мелкоочаговая деструкция ПЖ (табл. 3).
Наиболее часто у анализируемых больных обеих групп наблюдался инфицированный некроз ПЖ — у 35 (21,6 %) из 134 больных.
Нами последовательно был изучен ряд клинических и лабораторных показателей у больных основной группы, а также в динамике выполнялись УЗИ (100 %) и компьютерная томография (КТ) (35,3 % больных). Лапароскопия выполнена у 72,9 % больных второй клинической группы, у которых она также являлась и лечебным мероприятием.
Среди изученных показателей только шкала APACHE II, уровень CPБ, IL-8 в сыворотке крови больных были прогностически значимыми при развитии ВПИ (вторичной панкреатической инфекции) и СПОН у больных тяжелым ОП.
У всех больных с асептическим панкреонекрозом (1-я фаза заболевания) профилактические мероприятия, направленные на профилактику ВПИ и СПОН, мы начинали с момента госпитализации и продолжали до стабильной инволюции показателей воспалительного процесса ПЖ. Профилактика базировалась в основном на использовании системного введения лекарственных веществ. При этом главный акцент делали на профилактике как раннего, так и позднего, связанного с ВПИ, СПОН.
У больных первой клинической группы с асептическим массивным некрозом ПЖ необходимость профилактики ВПИ была связана с ранним хирургическим лечением у большинства больных (98,5 %), предпринимаемым в первые часы или дни с момента заболевания, из-за:
1) диагностической ошибки — 9,1 % больных;
2) сочетания тяжелого ОП с деструктивным холециститом — 10,6 % больных;
3) неэффективности консервативной терапии с нарастанием явлений перитонита — 74,2 % больных;
4) заболеваний билиарного генеза, нарастания явлений желтухи и отсутствия возможности разрешить ее эндоскопическим путем — 6,1 % больных.
При выполнении оперативных вмешательств в 1-й (системно-токсической) фазе заболевания наблюдается высокая летальность: от 22,2 % у больных с мелкоочаговым некрозом ПЖ до 50 % — при массивном некрозе ПЖ с обширным поражением забрюшинной клетчатки. Общая летальность в первой группе больных в 1-й фазе заболевания составила 34,8 % (23 больных), а у еще 36,4 % (24 пациента) развились те или иные формы ВПИ, что потребовало применения к ним повторных оперативных вмешательств.
Анализ оказания хирургической помощи больным первой клинической группы свидетельствует о том, что с целью предупреждения развития ВПИ следует избегать как вынужденных операций в ранние сроки заболевания, так и прямых вмешательств на ПЖ, так как все основные типы оперативных вмешательств, используемых у этой категории больных, создают условия как для прогрессирования токсического СПОН, так и для развития ВПИ и септического СПОН.
У 68 больных основной группы после проведения патогенетического лечения с учетом профилактической направленности против развития как ВПИ, так и СПОН общая летальность уменьшилась до 20,5 % (14 больных). Из них в 1?й (системно-токсической) фазе летальность составила 17,6 % (12 больных), во 2-й (септической) фазе умерло 2,9 % (2 человека). У 19,1 % (13 пациентов) отмечено развитие ВПИ, что потребовало применения к ним соответствующих оперативных вмешательств.
Основные принципы консервативного лечения у больных с тяжелым ОП должны включать следующие направления:
1) раннее блокирование ССВО — эффективные превентивные мероприятия для предотвращения аутодеструктивного процесса в тканях органов-мишеней, защита макрофагов, лимфоцитов, эндотелиальных клеток от их гиперактивации и истощения;
2) циркуляторная и респираторная поддержка, нормализация сердечного выброса, транспорта и потребления О2 для улучшения тканевой перфузии путем повышения сердечной преднагрузки, снижения постнагрузки, уменьшения эндотелиального отека;
3) устранение гуморальной сенсибилизации, что предотвращает последовательный паралич макрофагов. Более эффективной, с нашей точки зрения, в этом случае является детоксикация с помощью плазмафереза, которая должна носить упреждающий характер;
4) общая и органоспецифическая поддержка в целях предотвращения развития необратимых изменений в органах-мишенях;
5) обязательное назначение антибиотиков в связи с высокой вероятностью инфицирования очагов некроза ПЖ. Рациональный выбор антибиотического препарата, путей его введения и дозировки имеет жизненно важное значение. Однако необходимо помнить о том, что антимикробная терапия может вызвать парадоксальную индукцию септического шока (реакция Яриша — Герцгеймера), поскольку большинство антибактериальных препаратов обладают органотоксичностью и способны углубить СПОН;
6) оперативная коррекция при развитии гнойно-некротических процессов в поджелудочной железе, поскольку они способствуют как развитию, так и прогрессированию СПОН.
Продолжительность комплексной терапии должна составлять около 7–10 дней при легком и не менее 3 недель при тяжелом течении ОП. Как показали результаты наших исследований, лечение больных с умеренно выраженным ОП предпочтительнее осуществлять в специализированном отделении, а больных с тяжелым ОП — в отделении реанимации и интенсивной терапии. Это позволяет проводить полноценный мониторинг течения заболевания и быстро реагировать на возникновение возможных изменений.
К факторам риска, ведущим к развитию СПОН при ОП, относятся: пожилой возраст, поздняя госпитализация, наличие тяжелых сопутствующих заболеваний, диагностические ошибки, недостаточная коррекция гомеостаза как до, так и после оперативного вмешательства. Все эти факторы могут быть использованы для прогнозирования развития СПОН у больных ОП.
Выводы
1. Выполнение ранних оперативных вмешательств в первой (системно-токсическую) фазе ОП приводит к повышению летальности вследствие присоединения ВПИ (вторичной панкреатической инфекции) с последующим развитием СПОН.
2. Применение комплексной профилактической терапии, направленной на предотвращение развития токсической и септической СПОН, приводит к снижению летальности у больных ОП.
3. Оперативная коррекция при развитии гнойно-некротических процессов в ПЖ препятствует как развитию, так и прогрессированию СПОН.
Источник
